创新背景
转座元件(Transposable Elements,TE)是可以在基因组内移动的 DNA 片段,50%以上的人类基因组序列为 TE,其中大部分是非长末端重复(non-long terminal repeat,non-LTR)反转录转座子,例如 LINE-1、Alu 和 SVA 元件等。
但是,在人类漫长的进化过程中,绝大多数 TE 的完整结构被破坏而失去转座能力,并且逐渐被“驯化”成为基因组的一部分并发挥重要的功能,如对胎盘发育至关重要的 Syncytin-1/2 基因就是由TE衍变而来。但是相比起被大量研究的蛋白编码基因以及非编码 RNA,我们目前对于 TE 的功能还知之甚少,因此 TE 又被称为基因组中的“暗物质”。

H3K9me3是一种常见的抑制性组蛋白修饰,主要与异染色质的形成有关,在成体细胞中大量存在于逆转座子及部分基因启动子区域,通常被认为是细胞间命运转换的壁垒。
创新过程
2022年7月7日,中山大学中山医学院王继厂课题组联合孙逸仙纪念医院王文军教授团队,在 Cell Stem Cell 期刊发表了题为:Dynamic reprogramming of H3K9me3 at hominoid-specific retrotransposons during human preimplantation development 的研究论文。
为了解决传统 ChIP-seq 技术需要大量细胞(10^6~10^7)而人类早期胚胎不易获取的问题,研究团队开发了新的微量染色质免疫沉淀技术(AUCLiChIP-seq),将起始细胞量降到了50-100个细胞。随后,基于 AULiChIP-seq 技术绘制出首张人类植入前胚胎的 H3K9me3 修饰动态“景观图谱”,并发现 H3K9me3 主要富集在内源性逆转录病毒(ERV)、SVA、LINE-1 等反转录转座子上。此外,还发现 H3K9me3 分布还具有时间特异性,如在胚胎发育早期富集于谱系发育等相关基因周围,从而抑制这些基因过早地表达,进而确保对胚胎发育时序的精确分子调控。

研究团队进一步发现,在小鼠和人类合子基因组大规模激活(major zygotic genome activation,major ZGA)前,许多 major ZGA 基因的转录起始位点周围的染色质已经处于开放状态。在小鼠2细胞胚胎晚期,伴随着 major ZGA 基因的主体区域的 H3K9me3 重编程,这些基因开始转录。
但是与小鼠不同的是,人类 major ZGA 基因的启动子和主体上没有观察到 H3K9me3 等抑制性组蛋白修饰的富集,那么人类 major ZGA 启动时间(4-8细胞胚胎时期)为什么反而晚于小鼠(2细胞胚胎晚期)?
研究人员猜测这可能与远端调控元件增强子的激活时间有关。通过整合 Hi-C 以及 H3K9me3、H3K27ac 等组蛋白修饰数据,作者发现,直至人类8细胞胚胎时期,SVA 等类人猿特有的反转录转座子才发生大规模的 H3K9me3 去甲基化而成为活化的增强子,从而促进 major ZGA 基因的表达。
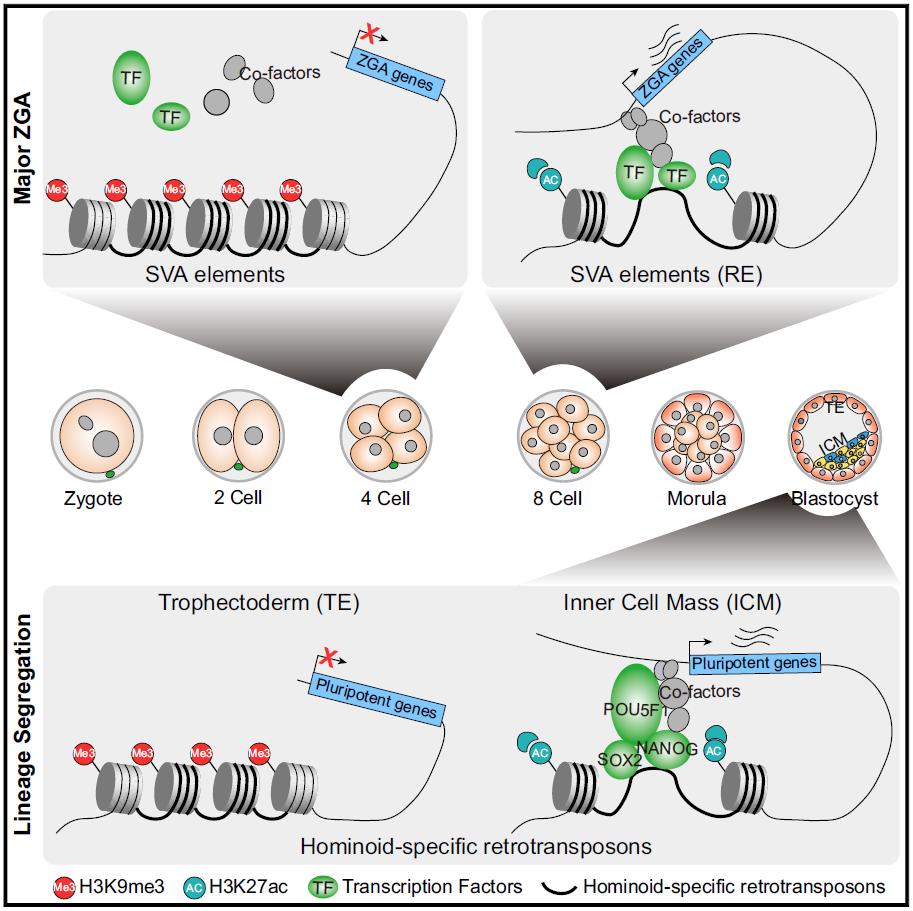
为了进一步验证 SVA 上 H3K9me3 重编程对人类 major ZGA 以及胚胎发育的重要性,作者建立了靶向 SVA 的表观基因组编辑系统以及微量细胞多组学分析技术 Pathul-seq(同时检测H3K9me3修饰和基因表达丰度)。
研究结果显示,在表观基因组编辑后的胚胎中,SVA 上 H3K9me3 修饰水平显著升高,其潜在调控的 major ZGA 基因表达随之受到抑制,并表现出发育迟缓、囊胚发育率降低等表型,提示 SVA 的活化是人类早期胚胎发育所必须的。
创新关键点
该研究建立了靶向 SVA 的表观基因组编辑系统以及微量细胞多组学分析技术 Pathul-seq,阐明了转座元件上 H3K9me3 依赖性异染色质的重塑在人类早期胚胎发育中的功能及其机制。
智能推荐
生物科学创新思维 | 自噬介导 ADAR1 蛋白调控细胞衰老新机制
2022-07-29该研究揭示了 ADAR1 缺失导致细胞衰老发生的重要功能,阐明了 ADAR1 以酶活不依赖的方式调控基因表达的关键机制,丰富了衰老标志物 p16 的转录后调控机理,并提示 ADAR1 蛋白水平降低可作为潜在的衰老生物标志物。
涉及学科涉及领域研究方向疫苗学创新思维 | 全新揭示肠道微生物组影响疫苗有效性的机制
2022-11-15通过研磨转基因米粒制成预防致命霍乱的新疫苗,第一次人体试验显示出良好的免疫反应,并且无明显副作用。
涉及学科涉及领域研究方向